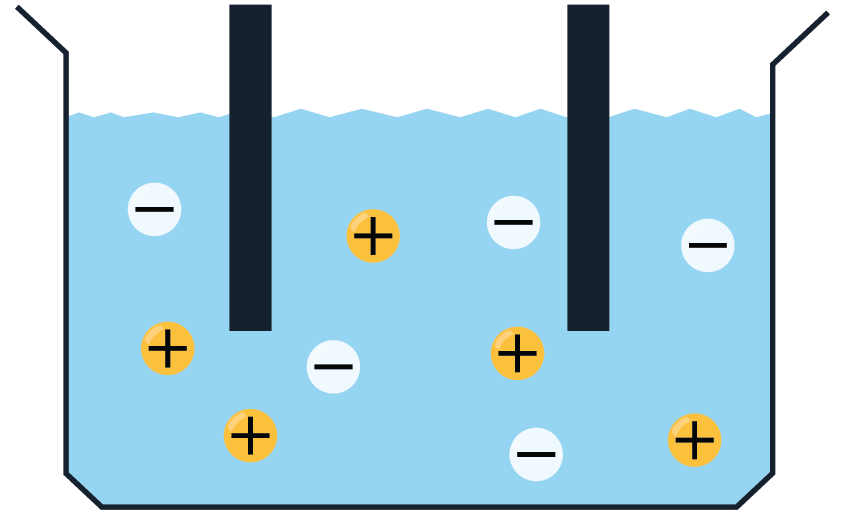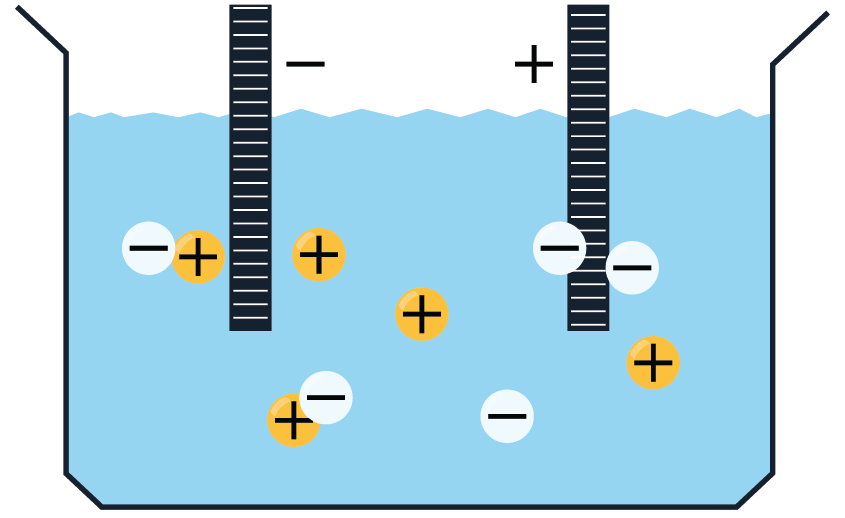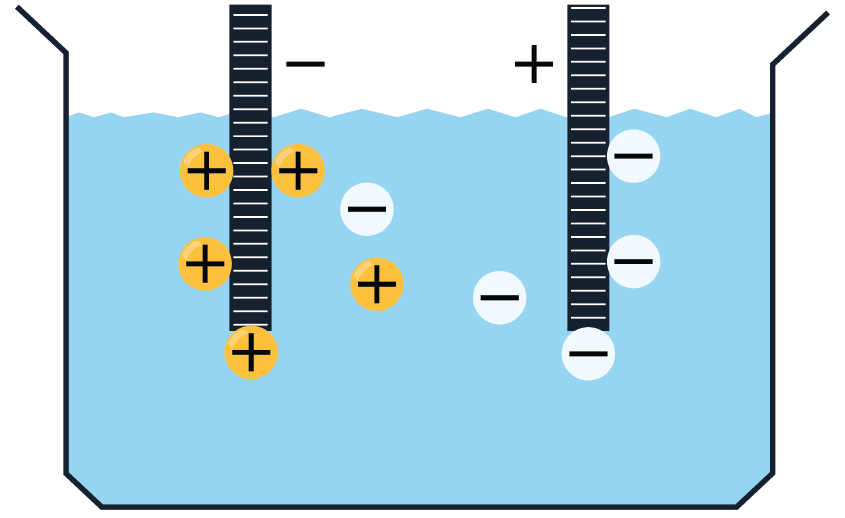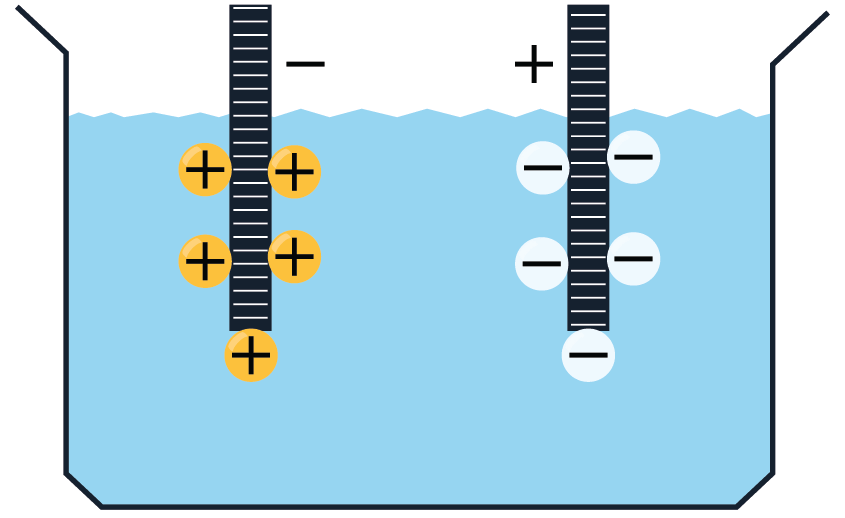
Šķidrumi arī var vadīt elektrisko strāvu. Piemēram, sāļu, skābju un sārmu šķīdumi ūdenī. Šķidrums kļūst par elektrības vadītāju, ja šķidrumā neitrālas molekulas disociē jonos. Ja tīrā ūdenī izšķīdina vārāmo sāli, tad tā molekulas sadalās pozitīvajos un negatīvajos jonos.
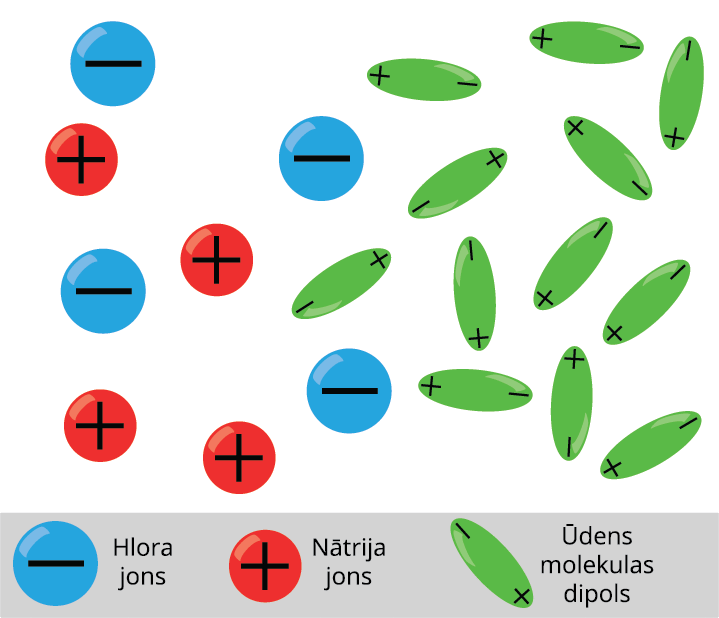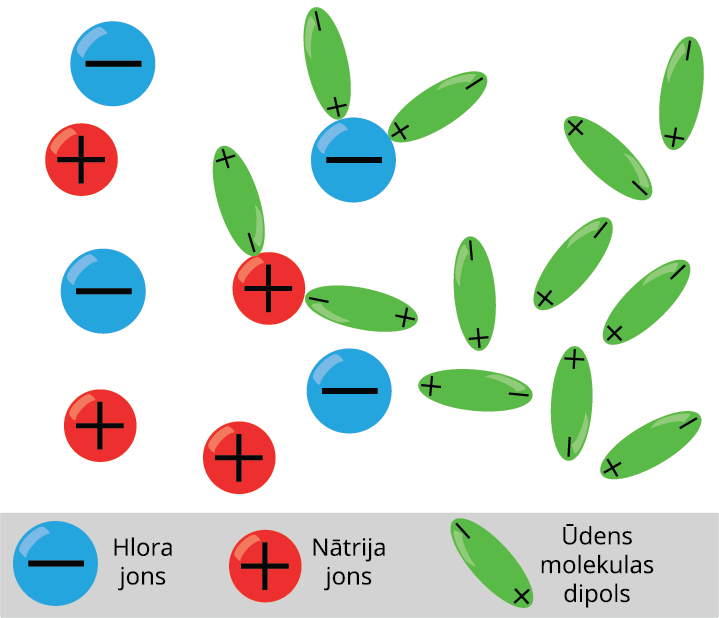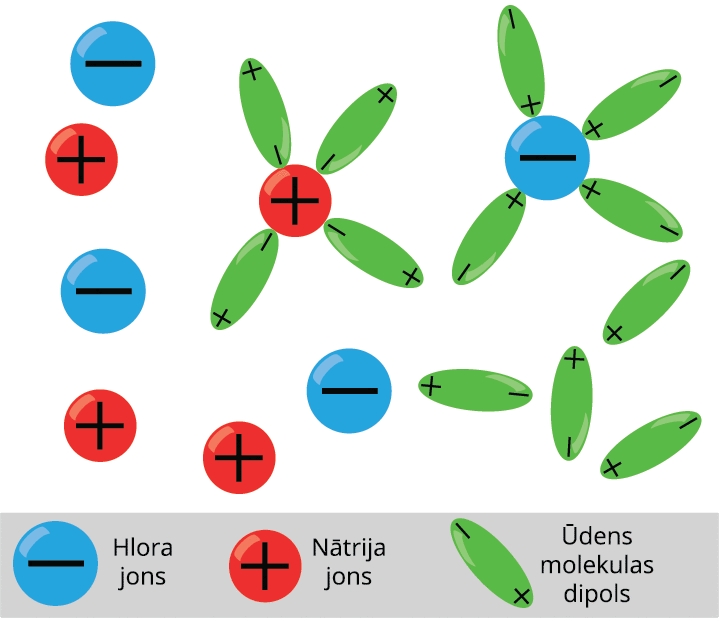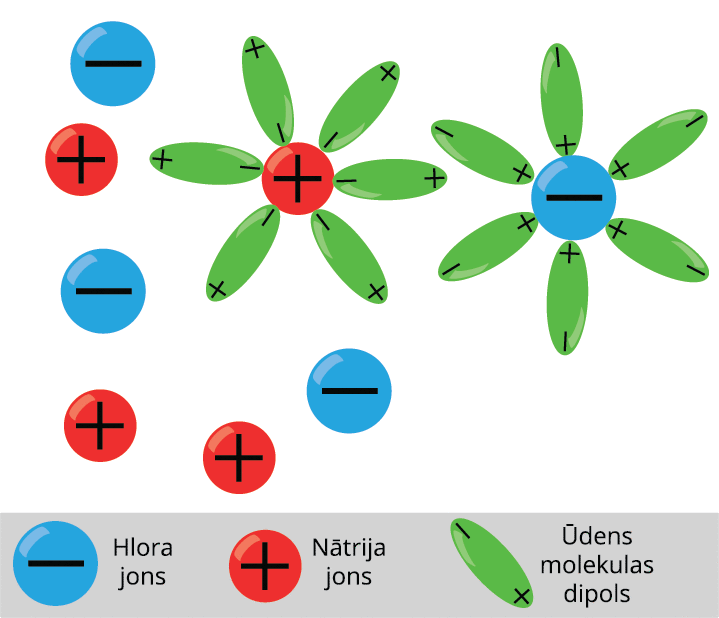
Šķidrumiem piemīt jonu vadītspēja
Elektrolītos brīvie lādiņnesēji atrodas nepārtrauktā haotiskā siltumkustībā. Ja elektrolītu ievietot elektriskā laukā, tad uz joniem darbojas spēks, kas izraisa jonu virzītu kustību, t.i. strāvu: pozitīvie joni virzās uz katodu, bet negatīvie — uz anodu.
Elektrolītu vadītspēja ir atkarīga no temperatūras. Palielinoties temperatūrai, molekulu siltumkustība kļūst intensīvāka un palielinās disociēto molekulu skaits, t.i. pieaug jonu skaits elektrolītā. Sakarā ar to elektrolīta pretestība samazinās.
Elektrolītu vadītspēja ir atkarīga no izšķīdušās vielas koncentrācijas. Ja tīrā ūdenī izšķīdināt maz vārāmās sāls, tad ūdenī rodas maz jonu. Ja palielināt vārāmā sāls koncentrāciju, disociācijas pakāpe pieaug un palielinās jonu skaits ūdenī.
Vielas izdalīšanos no elektrolīta, ja tajā plūst strāva, sauc par elektrolīzi.
Mūsdienās elektrolīzi plaši izmanto tīru metālu iegūšanā (vara, zelta, sudraba, alumīnija u.c.), virsmu pārklāšanai ar metāla kārtiņu (niķelēšana, hromēšana utt.), akumulatoros.
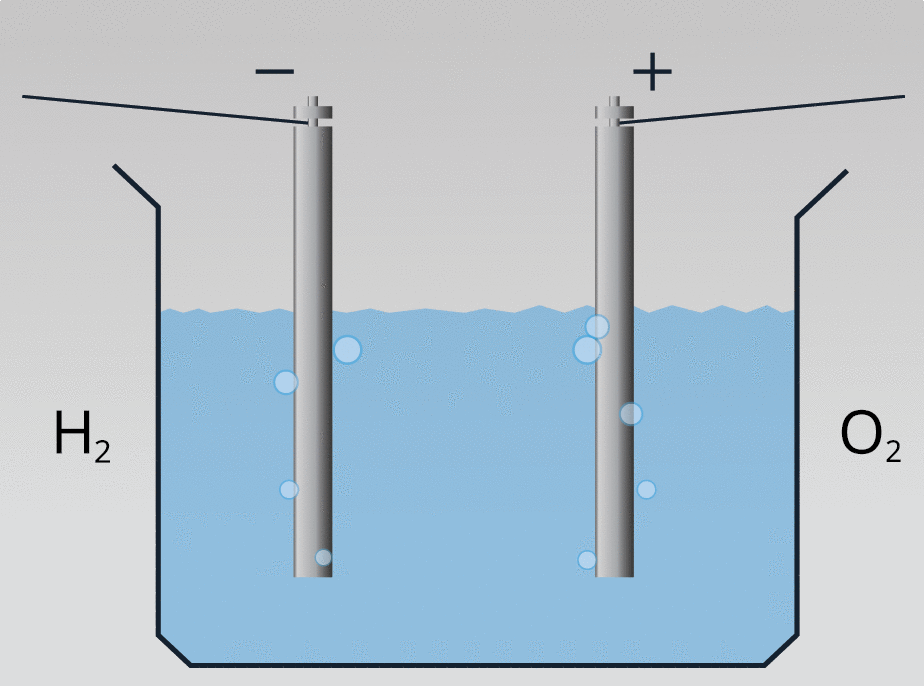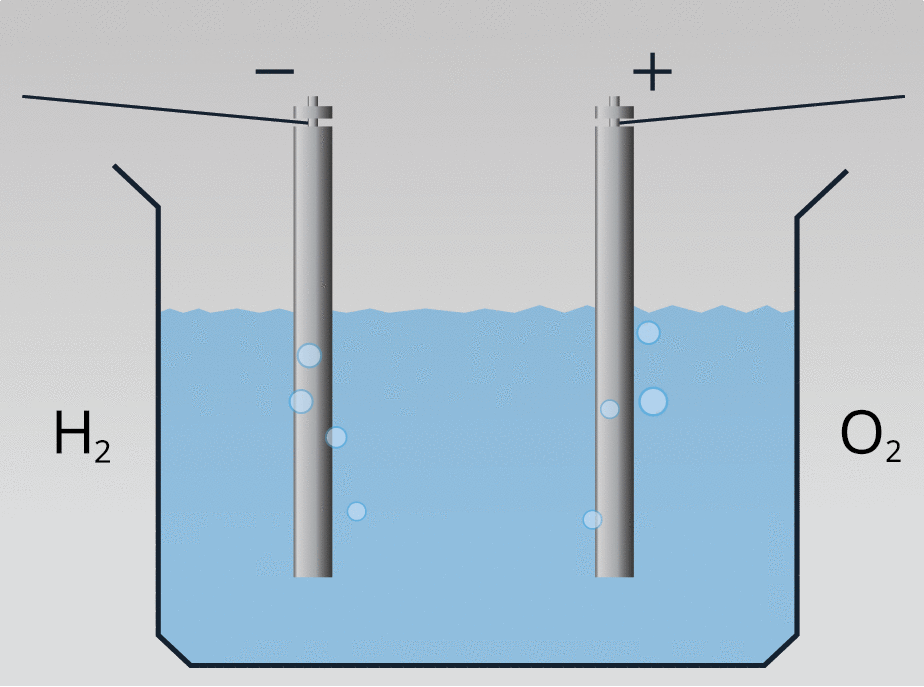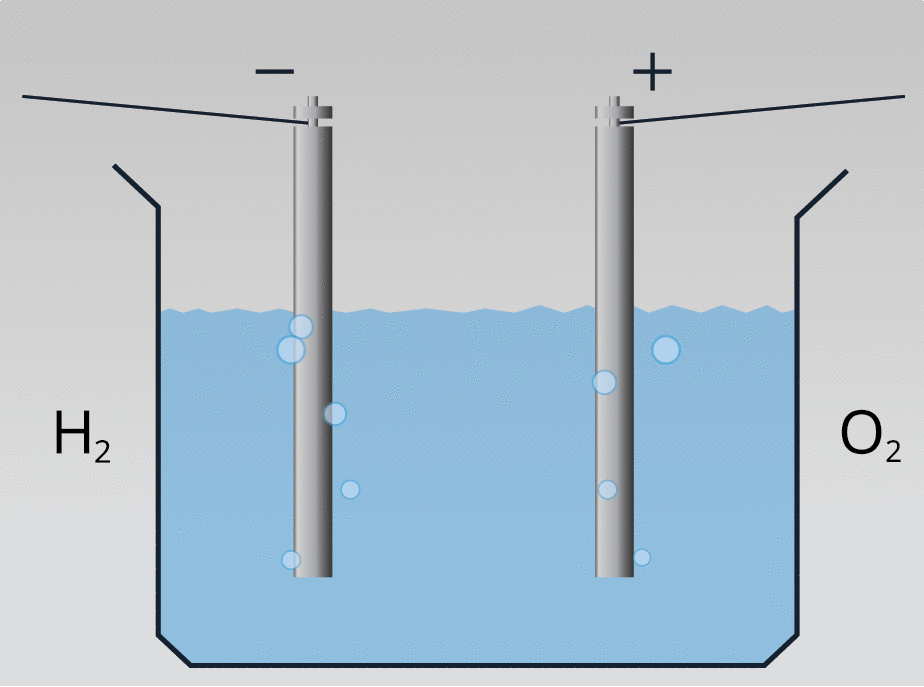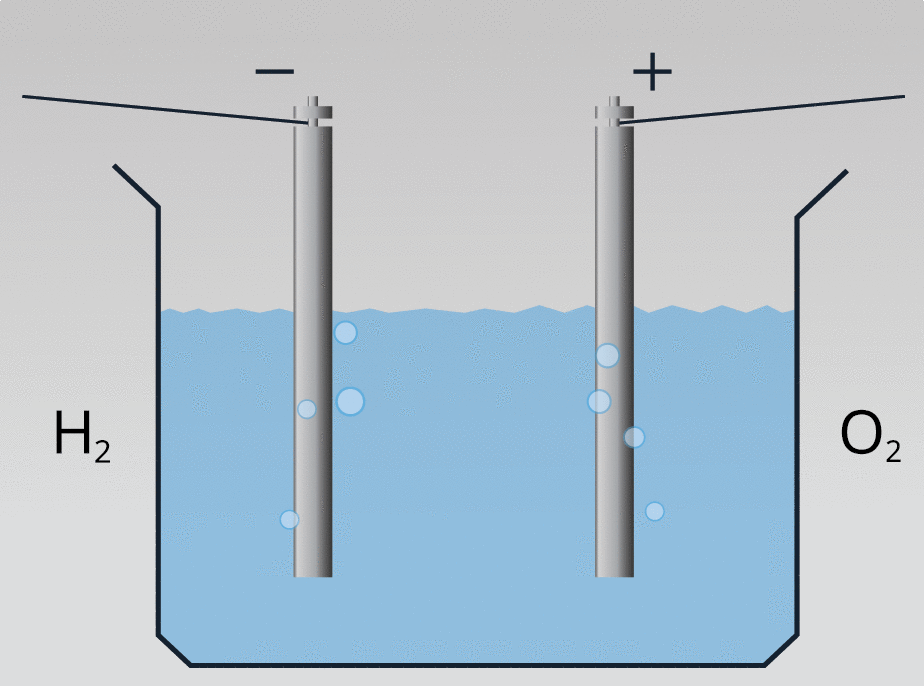
Plūstot elektriskai strāvai destilētā ūdenī, iegūst skābekli un ūdeņradi:
Ar ūdeņradi var iedarbināt ūdeņraža dzinēju:
