OTRĀ SEMESTRA NOSLĒGUMA TESTI
Kompleksie savienojumi jeb koordinācijas savienojumi ir neitrālas molekulas vai elektriski lādēti joni, kas veidojas, pie centrālā atoma (parasti metāla) pievienojoties citām molekulām vai joniem, ko sauc par ligandiem.
Atšķirībā no dubultsāļiem, kompleksie savienojumi maz disociē šķīdumos. Piemēram, kompleksais heksacianoferāta anjons šķīdumos eksistē kā viena vesela daļiņa, kas nedisociē dzelzs un cianīda jonos. Ir pazīstams liels skaits daudzveidīgu komplekso savienojumu (daudzi no tiem eksistē tikai šķīdumos). Neorganisko komplekso savienojumu ir ievērojami vairāk, nekā visu pārējo neorganisko savienojumu. Kompleksos savienojumus veido arī organiskas vielas un vairākiem no tiem ir milzīga nozīme dzīvajā dabā (hlorofils, hemoglobīns, B12 vitamīns).
Kompleksi veidojas donorakceptorās vai elektrostatiskās mijiedarbības dēļ starp kompleksus veidojošajām daļiņām. Tos var veidot gandrīz jebkurš periodiskās sistēmas elements. Kompleksus nelabprāt veido tipiskie metāli un tie ir tikai katjonu kompleksi, amfotērie metāli veido kā katjonu, tā anjonu kompleksus, bet nemetāli - anjonu kompleksus.
1893. gadā Šveices ķīmiķis Alfreds Verners (1866-1919) izskaidroja komplekso savienojumu uzbūvi.\
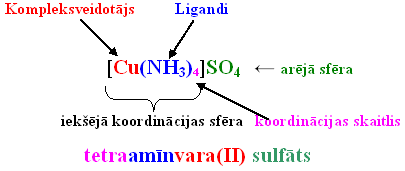
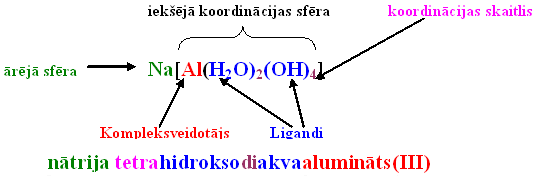
Komplekso savienojumu uzbūve
- Kompleksajā savienojumā viens no joniem vai atomiem ieņem centrālo vietu, un to sauc par kompleksveidotāju.
- Apkārt kompleksveidotājam izvietoti (koordinēti) pretēji lādēti joni vai elektriski neitrālas molekulas, ko sauc par ligandiem (no latīņu val. vārda ligare – saistīt, savienot).
- Kompleksveidotājs ar ligandiem veido savienojuma iekšējo sfēru, kuru, rakstot savienojuma ķīmisko formulu, ieslēdz kvadrātiekavās.
- Ar kompleksveidotāju tieši saistīto ligandu skaitu sauc par koordinācijas skaitli. Tas visbiežāk ir 2, 4, 6.
Komplekso savienojumu nosaukumu veidošana
Komplekso savienojumu nosaukumu veidošana ir atkarīga no tā, vai iekšējā sfēra ir katjons vai anjons.

- Vispirms nosauc katjonu, tad – anjonu.
- Iekšējai sfērai pirmos nosauc ligandus, norādot to skaitu. Ja kompleksajā jonā ir vairāki ligandi, tad pirmos nosauc negatīvos jonus, tad ūdens molekulas un beidzamās nosauc amonjaka molekulas.
- Pēdējo iekšējā sfērā nosauc kompleksveidotāju. Ja iekšējā sfēra ir katjons, tad kompleksveidotāju nosauc latviešu valodā un aiz nosaukuma iekavās norāda tā oksidēšanas pakāpes skaitlisko vērtību.
Ja iekšējā sfēra ir anjons, tad kompleksveidotāja nosaukumu atvasina no latīņu valodas nosaukuma, pievienojot galotni „-āts”, un iekavās norāda tā oksidēšanas pakāpes skaitlisko vērtību.
Ligandu nosaukumi:
- – bromo;
- – hloro;
- – fluoro;
- – hidrokso;
- – ciano;
- – nitrito;
- – nitrato;
- – karbono;
- – rodano;
- – amīn;
- – akva.
Koordinācijas skaitlis:
- 2 – di;
- 3 – tri;
- 4 – tetra;
- 5 – penta;
- 6 – heksa.
Atsauce:
http://lv.wikipedia.org/wiki/Kompleksie_savienojumi
http://dzm.lu.lv/kim/IT/K_11/default.aspx@tabid=21&id=220.html
http://dzm.lu.lv/kim/IT/K_11/default.aspx@tabid=21&id=220.html