PIRMĀ SEMESTRA NOSLĒGUMA TESTI
Oglekļa ķīmiskās īpašības
Parastajos apstākļos ogleklis ir ķīmiski inerts. Augstākās temperatūrās tā aktivitāte pieaug. Vislielākā reaģētspēja piemīt amorfajam ogleklim, mazāk aktīvs ir grafīts, bet dimantam ir viszemākā ķīmiskā aktivitāte. Ogleklis ir labs reducētājs, bet tā oksidējošās īpašības izpaužas vājāk. Parastajos apstākļos ogleklis reaģē tikai ar fluoru. Ar pārējiem halogēniem ogleklis tieši nesavienojas. Sakarsēts ogleklis gaisā aizdegas un veido oglekļa (IV) oksīdu (oglekļa dioksīdu). Augstā temperatūrā ogleklis savienojas arī ar citiem nemetāliem, piemēram, ar ūdeņradi, sēru.
Ogleklis ir nemetāls, taču ar metāliem tas savienojas tikai augstā temperatūrā, veidojot karbīdus.
Oglekļa reakcijās ar saliktām vielām izpaužas tā reducējošās īpašības, kuras izmanto galvenokārt metālu iegūšanai no to oksīdiem (karbotermija).
Sakarsēts kokss vai kokogle reaģē arī ar oglekļa (IV) oksīdu un ūdens tvaiku. Šīs reakcijas izmanto gāzveida kurināmā iegūšanai.
Oglekļa savienojumi
Oglekļa (II) oksīds (oglekļa monoksīds, tvana gāze)
molekulā gan ogleklis, gan skābeklis ir trīsvērtīgs, bet to oksidēšanas pakāpe ir attiecīgi +2 un -2.
rodas, ja caur degošu ogles slāni plūst gaiss nepietiekamā daudzumā. Vispirms veidojas oglekļa (IV) oksīds. Kvēlojošās ogles to reducē par :
Tā rodas tvana gāze krāsnīs un tā arī iegūst gāzveida kurināmo gāzģeneratoros un reducētāju karbotermijai. Oglekļa (II) oksīds veidojas, nepilnīgi sadegot šķidrajai degvielai - benzīnam, petrolejai, solāreļļai, tāpēc iekšdedzes dzinēju izplūdes gāzēs tilpumdaļa ir 2 ... 10 %. Pārslogota transporta kustība pilsētās, kā arī nepilnības iekšdedzes dzinēju darbībā rada lielu šīs gāzes koncentrāciju, tāpēc ir viena no tām galvenajām vielām (bez , aerosoliem), kas piesārņo atmosfēru.

ir bezkrāsaina, ļoti indīga gāze bez smaka. Tā ir nedaudz vieglāka par gaisu, slikti šķīst ūdenī, bet labi etanolā un benzolā. ir īpaši bīstama gāze, jo tā at hemoglobīnu saistās 200 ... 300 reizes ātrāk nekā skābeklis. Saindēšanās pazīmes ir galvassāpes, nelabums, vemšana. , ieelpota lielākos daudzumos izsauc bezspēku, bezsamaņu, nāvi. Tas nereti gadās slikti vēdinātās telpās - remontdarbnīcās un garāžās, kur darbina iekšdedzes dzinējus, kā arī ar krāsni apkurināmās telpās, ja priekšlaicīgi aizver krāsns aizbīdni.
ir sāļus neradošs oksīds. Tam raksturīgas savienošanās reakcijas. Piemēram, deg gaisā un skābeklī, izdalot lielu siltuma daudzumu. Saules gaismā vai aktīvās ogles klātbūtnē savienojas ar hloru, veidojot indīgu gāzi - fosgēnu:
lieto par reducētāju metalurģijā, par gāzveida kurināmo, par vērtīgu izejvielu neorganiskajā un organiskajā sintēzē.
Rūpniecībā oglekļa (II) oksīdu iegūst speciālās krāsnīs - gāzģeneratoros.
Oglekļa (IV) oksīds (oglekļa dioksīds, ogļskābā gāze)
nav indīgs, bet tam ir slāpējošas īpašības, tāpēc telpas, kurās uzturas daudz cilvēku, bieži jāvēdina.
satur arī okeāna un iekšzemes ūdeņi. Minerālūdeņos tā koncentrācija sasniedz 1,5 g/L.
dabā veidojas dažādos oksidēšanās procesos - elpošanā, pūšanā, degšanā. Lielos daudzumos tas izdalās no vulkāniem.
Sakarā ar industrializācijas nepārtrauktu palielināšanos arī daudzums gaisā pakāpeniski pieaug. Līdz ar to palielinās Zemes infrasarkanā starojuma absorbcija, ko dēvē par siltumnīcas efektu. Šī efekta ietekmē atmosfēras temperatūra lēni paaugstinās, un tas ar laiku var apdraudēt dzīvības eksistenci.

Rūpniecībā iegūst spirta rūgšanas procesā, kā arī termiski sadalot kaļķakmeni un dolomītu. Laboratorijā to iegūst, iedarbojoties uz marmoru vai citiem karbonātiem ar sālsskābi:
ir bezkrāsaina gāze bez smakas, 1,5 reizes smagāka par gaisu, labi šķīst ūdenī. Ja normālā spiedienā pakāpeniski atdzesē, tas nepārvēršas šķidrumā, bet -78,52 °C temperatūrā kristalizējas, veidojot sniegveida masu - sauso ledu, kam ir molekulu kristālrežģa struktūra. var sašķidrināt tikai paaugstinātā spiedienā.
ir skābais oksīds, kas, šķīstot ūdenī, veido nedaudz ogļskābes (process ir atgriezenisks):
reaģē ar bāziskajiem oksīdiem un sārmiem, tāpēc arī dzēstie un dedzinātie kaļķi gaisā pārvēršas par kalcija karbonātu.
iedarbību uz kaļķūdeni izmanto šīs gāzes pierādīšanai:
Paaugstinātā spiedienā reaģē ar amonjaku, veidojot karbamīdu (urīnvielu):
Spēcīgāku reducētāju ietekmē pilnīgi vai daļēji zaudē skābekli:
izmanto sodas, cukura, karbamīda, organisko skābju ražošanā, gāzētā ūdens pagatavošanai. To lieto ugunsdzēsībā, dažādās sintēzēs inertas atmosfēras radīšanai, lāzertehnikā. Sauso ledu izmanto zemas temperatūras uzturēšanai.
Ogļskābe un tās sāļi
Ogļskābe rodas, šķīdinot ūdenī. Tā ir nestabila un ļoti vāja skābe.
Ogļskābes sāļus sauc par karbonātiem. Ogļskābe veido normālos, skābos, bāziskos sāļus un dubultsāļus.
Fosgēns
Fosgēns jeb oglekļa (IV) oksohlorīds ir bezkrāsaina, ārkārtīgi indīga gāze ar vāju svaiga siena smaržu. Tā koncentrācija gaisā 5 jau ir bīstama. Lai gan fosgēns ir toksisks, to samērā plaši izmanto organiskajā sintēzē.
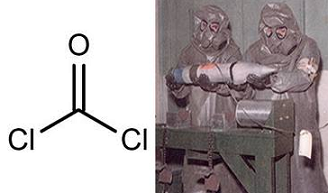
Pirmajā pasaules karā fosgēnu lietoja par indīgu kaujas vielu.
Karbamīds (urīnviela)
Karbamīds ir balta, ūdenī labi šķīstoša kristāliska viela, ko lieto par vērtīgu minerālmēslojumu un par piedevu atgremotājdzīvnieku barībai. To izmanto daudzu organisku vielu sintēzē.

Karbīdi
Karbīdi ir oglekļa savienojumi ar metāliem un citiem elementiem (B, Si), kuri attiecībā pret oglekli ir elektropozitīvi, piemēram, . Daudzu karbīdu sastāvs neatbilst parastajiem priekšstatiem par vērtību. Tās ir cietas, kristāliskas vielas, ko iegūst, karsējot metālus vai to oksīdus kopā ar ogli:
Aktīvo metālu karbīdi reaģē ar ūdeni (hidrolizējas) un ar atšķaidītām skābēm, veidojot metānu vai etīnu.
Kalcija karbīdu izmanto etīna (acetilēna) iegūšanai, ko savukārt lieto metināšanā un organiskajā sintēzē:
Ciānūdeņražskābe (zilskābe)
Zilskābe ir bezkrāsains, gaistošs šķidrums ar raksturīgu rūgto mandeļu smaržu. ir stipra inde, jo tā paralizē elpošanas centru un oksidēšanās procesus organismā. Nāvējoši iedarbojas pat tvaiki. ir vāja skābe.

Cianīdi ir ciānūdeņražskābes sāļi. Visplašāk izmanto kālija cianīdu . Tā ir bezkrāsaina, kristāliska viela, kas labi šķīst ūdenī un ir stipra inde. Kālija cianīdam ir ciānūdeņražskābes smarža, jo un iedarbības rezultātā tas izdala . Kālija cianīdu lieto zelta un sudraba izstrādājumu izdalīšanai no rūdām, jo tā ūdens šķīdumā un skābekļa klātienē izšķīst arī šie cēlmetāli, veidojot kompleksus savienojumus.
Sērogleklis
Sērogleklis ir bezkrāsains, gaistošs šķidrums, kas uzglabājot kļūst dzeltens un iegūst nepatīkamu smaku. viegli aizdegas. Sēroglekli lieto fosfora, sēra, joda un dažu organisko vielu šķīdināšanai, taču tā izmantošanas iespējas ir ierobežotas, jo tas ir toksisks.