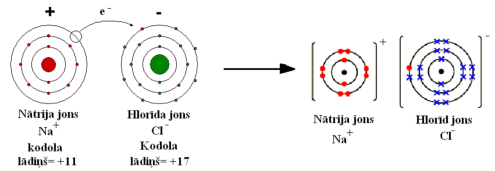
Vārāmā sāls jona veidošanās:
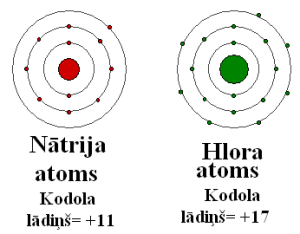
Nātrija atoma rādiuss ir lielāks par hlora atoma rādiusu. Hlora atoma kodols daudz stiprāk pievelk ārējā enerģijas līmeņa elektronus nekā nātrija kodols.
Pozitīvi un negatīvi lādētas daļiņas pievelkas.
Svarīgi!
Lielākais elektronu skaits, kas var atrasties 2.-7. perioda ķīmisko elementu atomiem ārējā enerģijas līmenī ir 8.

Hlorīdjona lādiņš= +17 (kodola lādiņš) - 18 (elektronu skaits jonā)= -1 (jona lādiņš)
Nātrija jona lādiņš = +11 (kodola lādiņš) - 10 (elektronu skaits jonā)= +1 (jona lādiņš)
Joni ir elektriski lādētas daļiņas, kas rodas, ja vielas atomi vai atomu grupas zaudē vai pievieno vienu vai vairākus elektronus.
Ja atoms zaudē vienu vai vairākus elektronus, veidojas pozitīvais jons jeb katjons. Ja atoms pievieno vienu vai vairākus elektronus, veidojas negatīvais jons jeb anjons.
Atsauce:
http://www.bbc.co.uk/schools/gcsebitesize/science/add_aqa_pre_2011/atomic/ionicrev5.shtml
http://www.bbc.co.uk/schools/gcsebitesize/science/add_gateway_pre_2011/periodictable/ionicbondingrev2.shtml