Molmasa ir vielas viena mola masa. Molmasas vienība ir grami molā (\(\mathrm{g/mol}\)).
Piemēram, etiķskābes \(\mathrm{CH_3COOH}\) molmasa ir
Aprēķinos izmanto arī atvasinātas vienības, piemēram, miligrami milimolā (\(\mathrm{mg/mmol}\)), kilogrami kilomolā (\(\mathrm{kg/kmol}\)), tonnas megamolā (\(\mathrm{t/Mmol}\)). Izvēloties atvasinātas vienības, molmasas skaitliskā vērtība nemainās. Piemēram, etiķskābes molmasa ir \(60\) (\(\mathrm{mg/mmol}\)), \(60\) (\(\mathrm{kg/kmol}\)) vai arī \(60\) (\(\mathrm{t/Mmol}\)).
Ja ir dota vielas struktūrformula, pirms aprēķina molmasu, ērtāk sākumā pārveidot to, uzrakstot vielas molekulāro formulu. Šādi mazina iespēju kļūdīties, aprēķinot katra ķīmiskā elementa atomu skaitu vielas molekulā.
Piemēram, ja vielai ir struktūrformula
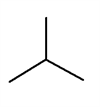 ,
, to pārraksta izvērstākā veidā
Lai aprēķinātu ķīmiskā elementa \(\mathrm{B}\) masas daļu \(w_\mathrm{B}\) savienojumā \(\mathrm{A}_a\mathrm{B}_b\mathrm{C}_c...\), šī ķīmiskā elementa masa \(m_\mathrm{B}\) jādala ar visas vielas masu \(m_{\mathrm{A}_a\mathrm{B}_b\mathrm{C}_c...}\) :
.
.
Pieņemot, ka vielas \(\mathrm{A}_a\mathrm{B}_b\mathrm{C}_c...\) daudzums ir viens mols, izteiksim šīs vielas masu:
Tā kā 1 mols vielas \(\mathrm{A}_a\mathrm{B}_b\mathrm{C}_c...\) satur \(b\) molus ķīmiskā elementa \(\mathrm{B}\), tad var aprēķināt arī, cik liela ir šī elementa masa:
Ievietojot abas izteiksmes formulā, kuru lieto masas daļas aprēķināšanai, iegūst vēl vienu formulu, kuru var izmantot, lai aprēķinātu elementa masas daļu savienojumā:
Piemēram, oglekļa masas daļa butānā \(\mathrm{C_4H_{10}}\) ir:
Materiālu izstrādāja M. Gorskis