Atomu elektronapvalka uzbūve
Elektroni orbitālēs novietojas saskaņā ar minimālās enerģijas principu, kuru 1951.gadā izstrādāja padomju agroķīmiķis Vsevolods Kļečkovskis.
Elektrons atomā novietojas tā, lai tā enerģija būtu vismazākā.
Elektrona enerģiju nosaka galvenais kvantu skaitlis n un orbitālais kvantu skaitlis l tāpēc elektrons novietojas tajā apakšlīmenī, kuram n un l summa ir mazākā.
Gadījumā, ja dažādos apakšlīmeņos n un l summa ir vienāda elektrons novietojas tajā apakšlīmenī, kuram ir mazāka galvenā kvantu skaitļa vērtība.
Ja orbitālē ir tikai viens elektrons, tad to sauc par nesapārotu elektronu, bet ja orbitālē ir divi elektroni - par sapārotiem elektroniem. Toties, ja orbitālē nav neviena elektrona to sauc par brīvo orbitāli.
Rakstot p un d apakšlīmeņu aizpildīšanos, jāievēro, ka elektroni apakšlīmenī izvietojas saskaņā ar Hunda likumu.
Vienāda orbitālā kvantu skaitļa gadījumā elektroni novietojas tā, lai p un d elektronu spinu summa būtu maksimāla.
Tātad orbitālēs vispirms novietojas pa vienam elektronam ar vienādi vērstiem spiniem un tikai pēc tam sāk veidoties elektronu pāri.
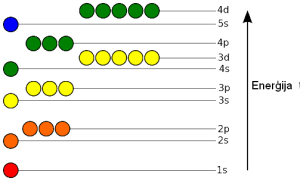
Elektronapvalka enerģētisko apakšlīmeņu aizpildīšanās secība.
Atsauce:
http://commons.wikimedia.org/wiki/File:Atomic_orbital_energy_levels.svg
A.Buiva "Vispārīgā ķīmija vidusskolām" 1997. 51-55