Galvaniskais elements
Par elektrodu sauc elektrolīta šķīdumā iegremdētu metālu. Metāla kristālrežģis sastāv no pozitīviem metāla joniem. Šajā jonu kristālrežģī brīvi pārvietojas metālu valences (galveno apakšgrupu metāliem – ārējā elektronu enerģijas līmeņa) elektroni, kas ir visiem metāla joniem kopīgi, – tā saucamā elektronu gāze. Šādas uzbūves dēļ šķīdumā iegremdēts metāls var izšķīdušās vielas daļiņām atdot vai no tām pieņemt elektronus, tādējādi iegūstot elektrisku lādiņu un potenciālu. Potenciāla rašanās notiek arī tad, ja paša metāla joni no metāla virsmas pāriet šķīdumā vai no šķīduma izgulsnējas uz virsmas.
Lai elektriskā ķēde būtu noslēgta, šķīdumā jāiegremdē vēl viens elektrods un tas jāpieslēdz otrai mērinstrumenta spailei. Šādi esam ieguvuši galvanisko elementu. Galvaniskais elements sastāv no diviem šķīdumā iegremdētiem elektrodiem, kas savā starpā savienoti ar metāla vadu.
Mērinstruments, kas pieslēgts starp abiem galvanisko elementu veidojošajiem elektrodiem neuzrādīs atsevišķa elektroda potenciālu, bet gan galvaniskā elementa elektrodzinējspēku (EDS)
Mērinstruments, kas pieslēgts starp abiem galvanisko elementu veidojošajiem elektrodiem neuzrādīs atsevišķa elektroda potenciālu, bet gan galvaniskā elementa elektrodzinējspēku (EDS)
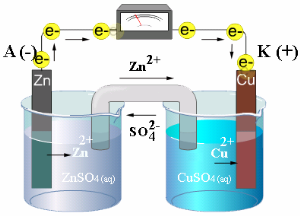
Vara - cinka galvaniskais elements.
Lai varētu savā starpā salīdzināt dažādu elektrodu potenciālus, tos mēra relatīvi – attiecībā pret ūdeņraža standartelektrodu, kura potenciālu nosacīti pieņem par nulli.
Elektroda potenciālu aprēķina, izmantojot Nernsta vienādojumu:
kur E – elektroda potenciāls, V,
– elektroda standartpotenciāls;
R – universālā gāzu konstante, J/mol⋅K,
F – Faradeja skaitlis, C/mol,
n – elektroķīmiskajā reakcijā piedalošos elektronu skaits,
K – uz elektroda notiekošās pusreakcijas līdzsvara konstante,
– elektroda standartpotenciāls;
R – universālā gāzu konstante, J/mol⋅K,
F – Faradeja skaitlis, C/mol,
n – elektroķīmiskajā reakcijā piedalošos elektronu skaits,
K – uz elektroda notiekošās pusreakcijas līdzsvara konstante,
T – temperatūra, K .
Ja Nernsta vienādojuma izteiksmē pāriet no naturālā logaritma uz decimālo un ievieto skaitlisko konstanšu vērtības, tad standartapstākļiem () vienādojums iegūst šādu formu:
Elektrodu iedalījums
Pēc lietošanas veida elektrodus iedala indikatorelektrodos un salīdzināšanas elektrodos jeb normālelektrodos.
Indikatorelektrodi ir elektrodi, kuru potenciāls ir atkarīgs no tā šķīduma īpašībām, kurā tie iegremdēti (parasti no kādas vielas vai jona koncentrācijas šķīdumā). Šādus elektrodus var lietot, lai pēc to potenciāla spriestu par attiecīgās vielas (jona) koncentrāciju.
Normālelektrodi (salīdzināšanas elektrodi) ir tādi elektrodi, kuru potenciāls ir konstants. Normālelektrodu uzbūvē parasti ietilpst savs iekšējs šķīdums, kuram nav tiešas saskares ar pētāmo šķīdumu. Šis apstāklis tad arī nodrošina normālelektrodu potenciāla neatkarību no pētāmā šķīduma īpašībām. Šos elektrodus slēdz galvaniskajos elementos ar indikatorelektrodiem, lai attiecībā pret tiem varētu mērīt indikatorelektrodu potenciālus.
Atsauce:
http://www.vispariga-kimija.lv/home/satura-raditajs