Jonu saite
Ķīmisko saiti, kura veidojas starp pozitīvi un negatīvi lādētiem joniem, sauc par jonu saiti.
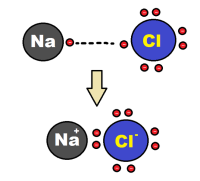 | Jonu ķīmiskā saite pastāv savienojumos, kuru sastāvā ir gan elementi ar ļoti mazu elektronegativitāti (tipisks metāls), gan elements ar ļoti lielu elektronegativitāti (tipisks nemetāls). |
Metāliskā saite
Metāliem ir neliela elektronegativitāte, tāpēc tie viegli zaudē elektronus pārvēršoties par pozitīvi lādētiem joniem.
Ķīmisko saiti, kuras veidošanā piedalās brīvie valences elektroni (elektronu gāze), kas sadalīti pa visu metālisko elementu atomu un jonu veidoto kristālrežģi, sauc par metālisko saiti.
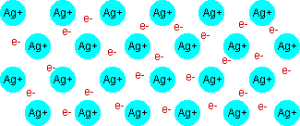
Metāliskā saite pastāv metālos un sakausējumos.
Jebkurš metāls vai sakausējums sastāv no pozitīvi lādētiem atomjoniem un no brīviem, negatīvi lādētiem elektroniem.
Ūdeņraža saite
Ūdeņraža saite ir saite jeb pievilkšanās spēks, kas veidojas starp stipri elektronegatīva elementa atomu (F, O, N) un ūdeņraža atoma kodolu (protonu), kuru savukārt kovalentās saites saista ar citiem elektronegatīviem atomiem tai pašā vai citā molekulā.
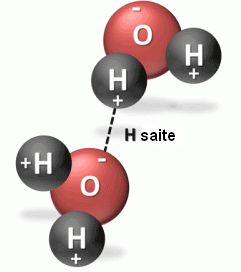 | Attēlā redzama ūdeņraža saite starp divām ūdens molekulām. Ir iespējamas starpmolekulārās (intermolekulārās) ūdeņraža saites un iekšmolekulārās (intramolekulārās) ūdeņraža saites. Iekšmolekulārās ūdeņraža saites nosaka daudzu dabasvielu - proteīnu un nukleīnskābju - struktūru. |
Atsauce:
http://lv.wikipedia.org/wiki/%C5%AAde%C5%86ra%C5%BEa_saite
http://lv.wikipedia.org/wiki/%C4%B6%C4%ABmisk%C4%81_saite
http://131.91.162.18/nasa/module-3/why-does-temperature-vary/land-and-water
http://www.chemistry.sudeshnapaul.com/chemicalbonds.html
http://commons.wikimedia.org/wiki/File:IonicBondingRH11.png