Brīvā jeb Gibsa enerģija
Ķīmiskajos procesos vienlaikus darbojas divas tendences: daļiņu tieksme apvienoties komplicētākos veidojumos, tādā veidā samazinot entalpiju, un daļiņu tieksme attālināties citai no citas, tādējādi palielinot entropiju. Šo divu pretējo tendenču summāro efektu procesos, kuri norisinās pie konstantas temperatūras un spiediena, parāda Gibsa enerģija. Gibsa enerģiju sauc arī par izobāri izotermisko potenciālu vai brīvo enerģiju.
Izobārā potenciāla izmaiņas raksturs ļauj spriest par to, vai procesu ir iespējams realizēt. Ja Gibsa enerģija reakcijas procesā samazinās, tad process ir iespējams un turpināsies patvaļīgi, bet ja palielinās, tad tas liecina par procesa patvaļīgas realizācijas neiespējamību konkrētajos apstākļos. Ja enerģija nemainās, tad sistēmā ir iestājies ķīmiskais līdzsvars.
Entalpija | Entropija | Patvaļīgums |
(eksotermiska) | Jā | |
(eksotermiska) | Jā, ja | |
(endotermiska) | Jā, ja | |
(endotermiska) | Nē |
Tāpat kā entalpiju, vienkāršu vielu izobāro rašanās potenciālu pieņem vienādu ar nulli.
Tāpat kā sistēmas entalpijas un entropijas izmaiņas, arī izobārā potenciāla izmaiņas nav atkarīgas no procesa ceļa.
Izobārā potenciāla izmaiņu var arī aprēķināt līdzīgi kā entalpiju un entropiju izmaiņas, no reakcijas produktu izobāro rašanās potenciālu summas atņemot izejvielu izobāro rašanās potenciālu summu:
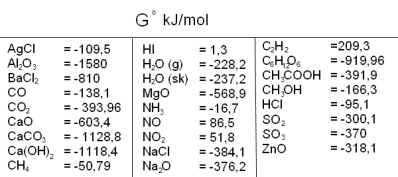
Atsauce:
N.Ahmetovs "Neorganiskā ķīmija" 193.-198.lpp
https://moodle.rtu.lv/public/course/view.php?id=38809