Ja savienošanās reakcijā no divām vai vairākām vielām rodas viena jauna viela, tad pastāv ķīmiskās reakcijas, kurās viss notiek otrādi.
Par sadalīšanās reakcijām sauc ķīmiskās reakcijas kuru gaitā no vienas vielas rodas divas vai vairākas jaunas vielas.
Shematiski sadalīšanās reakcijas var attēlot šādi:
Par sadalīšanās reakcijām sauc ķīmiskās reakcijas kuru gaitā no vienas vielas rodas divas vai vairākas jaunas vielas.
Shematiski sadalīšanās reakcijas var attēlot šādi:
\(\underbrace A_{izejvielas}\rightarrow \underbrace {B+C}_ {reakcijas\\ produkts}\)
Sadalīšanas reakcijas var izmantot piemēram, lai iegūtu skābekli.
1. Skābekli var iegūt sadalot ūdeni ar elektrisko strāvu.
1. Skābekli var iegūt sadalot ūdeni ar elektrisko strāvu.
To var izdarīt iekārtā, kuru sauc par Hofmaņa aparātu (attēlā). Iekārtā ielej ūdeni un ieslēdz elektrisko strāvu. Ūdens sāk sadalīties:
\(2H_2O\xrightarrow {elektriskā\; strāva} 2H_2 \uparrow +\; O_2 \uparrow\)
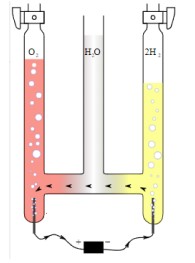
Attēls. Hofmaņa aparāta shēma.
2. Skābekli var iegūt sadalot ūdeņraža peroksīdu jeb ūdeņraža pārskābi \(H_2O_2\).
Atšķaidītu \((3\%)\) ūdeņraža peroksīda šķīdumu izmanto medicīnā kā dezinficējošo līdzekli. Pats šķīdums ir diezgan stabils – var ilgstoši saglabāties nemainoties. Bet ja šķīdumā tiek asins, tās sāk strauji sadalīties, izdalot skābekli.
Šādu efektu var novērot arī pievienojot ūdeņraža peroksīda šķīdumam mangāna(IV) oksīdu \(MnO_2\). Pats mangāna(IV) oksīds šīs reakcijas gaita neizlietojas, viela tikai paātrina ūdeņraža peroksīda sadalīšanos:
Šādu efektu var novērot arī pievienojot ūdeņraža peroksīda šķīdumam mangāna(IV) oksīdu \(MnO_2\). Pats mangāna(IV) oksīds šīs reakcijas gaita neizlietojas, viela tikai paātrina ūdeņraža peroksīda sadalīšanos:
\(2H_2O_2 \xrightarrow {MnO_2} 2H_2O +\; O_2 \uparrow\)
Vielas kuras paatrina ķīmiskās reakcijas, bet pašas reakcijas gaita neizlietojas, sauc par katalizatoriem.
Iekārta, kur no ūdeņraža peroksīda var iegūt skābekli un uzkrāt to, var izskatīties šādi.
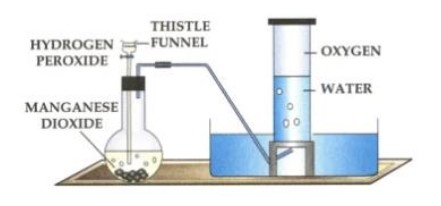
Attēls. Iekārta skābekļa iegūšanai no ūdeņraža peroksīda.
Pilināmā piltuvē atrodas ūdeņraža peroksīda šķīdums. Stāvkolbā ievietots katalizators \(MnO_2\). Ūdeņraža peroksīda šķīdums pakāpeniski pil no piltuves, saskaroties ar katalizatoru peroksīds sadalās. Gāzveida skābeklis, kas izdalās pa gāznovadcauruli nonāk cilindrā, kas iepriekš ir aizpildīts ar ūdeni. Skābeklis slikti šķīst ūdenī, tāpēc ūdens no cilindra pakāpeniski tiek izspiests.
Tas, ka cilindrā uzkrāts skābeklis, var pārliecināties šajā traukā ienesot kvēlojošo skaliņu. Skaliņa galā kvēlo oglīte. Skābekļa klātbūtnē oglīte uzliesmo:
Tas, ka cilindrā uzkrāts skābeklis, var pārliecināties šajā traukā ienesot kvēlojošo skaliņu. Skaliņa galā kvēlo oglīte. Skābekļa klātbūtnē oglīte uzliesmo:
\(C+O_2 \rightarrow CO_2\)
3. Skābeklis izdalās sadaloties kālija hlorātam jeb Bertolē sālim \(KClO_3\).
Bertolē sāls atrodas sērkociņa galviņā. Sastāvā ir arī atbilstošs katalizators \((MnO_2)\) un sērs. Berzējot sērkociņu gar kastīti, sērkociņa galviņa uzsilst, un Bertolē sāls sadalās, izdalot skābekli:
\(2KClO_3\xrightarrow {katalizators} 2KCl + 3O_2 \uparrow\)
Skābeklis, kas izdalās, veicina sēra aizdegšanos. Tālāk aizdegas arī sērkociņa kociņš.
Eksperimentu par skābekļa iegūšanu no Bertolē sāls laboratorijā var realizēt iekārtā, kas sastāv no mēģenes, gāznovadcaurules un vārglāzes. Bertolē sāls un katalizatora maisījumu karsējot (šīm nolūkam var izmantot spirta lampiņu), skābeklis izdalās un pa gāznovadcauruli nonāk vārglāzē. Vārglāzē pirms eksperimenta sākuma atrodas gaiss. Skābeklis ir drusciņ smagāks par gaisu, uzkrājas vārglāzes dibenā tādejādi izspiežot gaisu no trauka.
Eksperimentu par skābekļa iegūšanu no Bertolē sāls laboratorijā var realizēt iekārtā, kas sastāv no mēģenes, gāznovadcaurules un vārglāzes. Bertolē sāls un katalizatora maisījumu karsējot (šīm nolūkam var izmantot spirta lampiņu), skābeklis izdalās un pa gāznovadcauruli nonāk vārglāzē. Vārglāzē pirms eksperimenta sākuma atrodas gaiss. Skābeklis ir drusciņ smagāks par gaisu, uzkrājas vārglāzes dibenā tādejādi izspiežot gaisu no trauka.
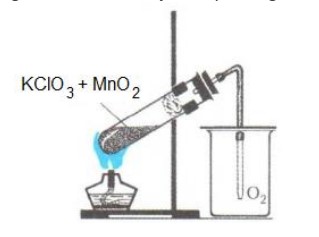
Attēls. Skābekļa iegūšana no kālija hlorāta (Bertolē sāls).
Rūpniecībā skābekli iegūst no gaisa iepriekš zem paaugstinātā spiediena to sašķidrinot un pēc tam destilējot.
Tabula. Dažu gaisā esošo vielu viršanas temperatūra.
Rūpniecībā skābekli iegūst no gaisa iepriekš zem paaugstinātā spiediena to sašķidrinot un pēc tam destilējot.
Tabula. Dažu gaisā esošo vielu viršanas temperatūra.
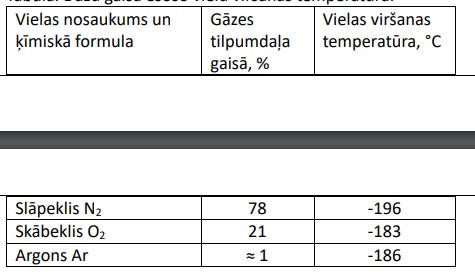
Destilējot sākumā iztvaiko slāpeklis, pēc tam argons un paliek šķidrs skābeklis.
Skābekli transportē un uzglabā tērauda balonos.
Pēdējā laikā gāzu sadalīšanai jo plašāk sāka izmantot speciālas membrānas – poraino materiālu ar ļoti sīkiem caurumiem, caur kuriem var iziet gāzveida vielas molekulas, kurām ir noteikts diametrs.
Skābekli transportē un uzglabā tērauda balonos.
Pēdējā laikā gāzu sadalīšanai jo plašāk sāka izmantot speciālas membrānas – poraino materiālu ar ļoti sīkiem caurumiem, caur kuriem var iziet gāzveida vielas molekulas, kurām ir noteikts diametrs.