Metālu reakcijas ar saliktām vielām
Metālu ķīmisko aktivitāti redoks reakcijās ūdens šķīdumos raksturo metāla redoks potenciāls. Ar tā palīdzību var spriest par iespējamās redoks reakcijas virzienu. Redoks reakcija ir iespējama, ja oksidētāja redoks potenciāls ir lielāks par reducētāja redoks potenciālu > un reakcijas elektrodzinējspēks E (EDS) ir pozitīvs lielums:
E=->0
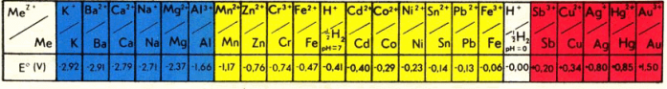
Metālu spriegumu rinda
Metālu reakcijas ar ūdeni
Šīs reakcijas notiek tad, ja ūdeņraža elektroda potenciāls ir lielāks par metāla elektroda potenciālu.
Ūdeņraža redoks potenciāls ir atkarīgs no pH un standartapstākļos sakarību raksturo vienādojums:
E= -0,059pH (V) |
Neitrālā vidē ūdeņraža redoks potenciāla vērtība ir -0,41 V, tātad ar ūdeni var reaģēt visi tie metāli, kuru redoks potenciālu vērtība ir mazāka par -0,41 V.
Tomēr tīrs alumīnijs un cinks parastos apstākļos ar ūdeni vispār nereaģē,jo to hidroksīdi, tāpat kā svina un alvas (II) hidroksīdi ir ūdenī nešķīstoši savienojumi un aizkavē ūdens piekļūšanu metāla virsmai.
Metālu reakcijas ar sārmu ūdens šķīdumiem
Arī šajos šķīdumos notiek metālu reakcijas ar ūdeni. Sārmainā vidē ūdeņraža redoks potenciāla vērtība ir -0,83 V, tātad ar ūdeni reaģēs tie metāli, kuru redoks potenciālu vērtība ir mazāka par -0,83 V.
Ja metāls ir pārklāts ar ūdenī nešķīstoša oksīda kārtiņu vai reakcijās ar ūdeni veidojas nešķīstoši hidroksīdi , tad reakcijas ar ūdeni nenotiek.
Ja metālu oksīdi un hidroksīdi ir amfotēri savienojumi, tie reaģē ar sārmiem, veidojot šķīstošus kompleksus savienojumus:
Metālu reakcijas ar sāļu ūdens šķīdumiem
Šajā gadījumā iespējami vairāki procesi:
1) Sāls šķīdumā atrodas metāla katjoni, kuri var būt pietiekami spēcīgi oksidētāji, lai oksidētu metālus, kuri ir par tiem aktīvāki:
2) Dažu sāļu katjonu vai anjonu hidrolīzes (protolīzes) rezultātā šķīduma pH var atšķirties no neitrāla šķīduma pH, veidojoties skābai vai sārmainai videi.
3) Metāls var reaģēt ar skābēm vai sārmiem, kas ir radušies šķīdumā hidrolīzes (protolīzes) rezultātā.
Piemērs:
Alumīnijs nātrija karbonāta šķīdumā
1) Nātrija joni nevar oksidēt alumīniju , jo - reakcija nenotiek
2) Karbonāta joni hidrolizējas (protolizējas), veidojot sārmainu vidi:
3) Alumīnija reakcija ar hidrolīzes (protolīzes) produktu NaOH:
Atsauce:
https://moodle.rtu.lv/public/course/view.php?id=38809