OTRĀ SEMESTRA NOSLĒGUMA TESTI
Metāli
Metāli ir tādu elementu veidotās vienkāršās vielas vai to sakausējumi, kuriem piemīt metāliskas īpašības (salīdzinoši laba siltumvadītspēja un elektrovadītspēja, metālisks spīdums, plastiskums u.c.).
Lielākā daļa metālu brīvā veidā nav stabili un oksidējas (korodē), veidojot stabilākus savienojumus.
Visus elementus iedala metālos, nemetālos un metaloīdos jeb pusmetālos.
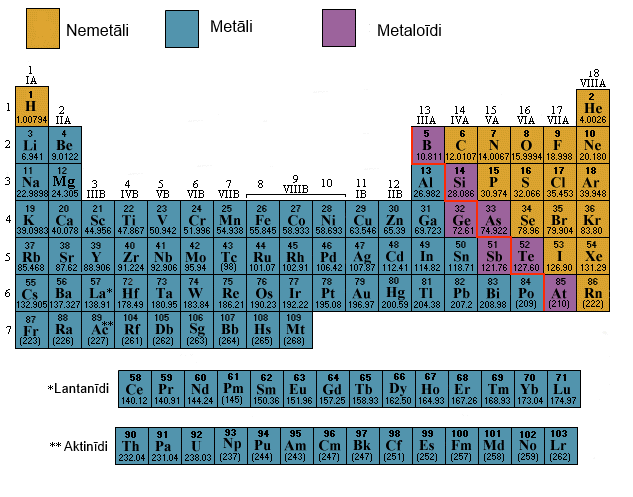
Metālu iedalījums
Pēc blīvuma:
| vieglie metāli | < 5 | IA, IIA grupas, Al, Y, Ti Visvieglākais litijs, = 0,53 |
| smagie metāli | > 5 | Vissmagākais ir osmijs, = 22,5 |
Pēc kušanas temperatūras:
| viegli kūstošie | < 1000 | s- un p- elementi (izņemot Be), IIB grupa (Zn, Cd), Ag un La. |
| vidēji kūstošie | = 1000 - 1500 | Mn, Co, Ni, Be, Au, Cu, Ac, Fe, (1534 ) u.c. |
| grūti kūstošie | > 1500 | Ti, V, Cr, Mo, W (3410 ) u.c. |
Metālu iegūšana
1) Pirometalurģija - metālu un to sakausējumu iegūšanas un attīrīšanas procesu kopums, kurā izmanto reducētājus un augstu temperatūru.
a) Karbotermija
Pirometalurģijas metode, kurā metālu reducēšanai no to oksīdiem izmanto koksu, vai kokogli.
b) Metalotermija
Pirometalurģijas metode, kurā metālu reducēšanai lieto aktīvus metālus. Metalotermijā visbiežāk izmanto alumīniju, tad šo metodi sauc par alumotermiju. Alumotermiski reducē oksīdus
2) Elektrometalurģija - metālu iegūšanai izmanto elektrolīzi. Elektrolīze ir oksidēšanās - reducēšanās process, kas noris uz elektrodiem, ja caur elektrolīta šķīdumu vai kausējumu no ārējā strāvas avota plūst līdzstrāva.
Elektrometalurģijā elektrolīzes procesos par elektrolītiem lieto izejvielas, no kurām jaiegūst metāls. Visbiežāk tie ir sāļi , retāk sārmi (KOH) un oksīdi.
3) Hidrometalurģija - metālu iegūšana no rūdām, iežiem un metalurģijas atkritumiem, tos apstrādājot ar ķīmisko reaģentu ūdens šķīdumiem.
Hidrometalurģijas beigu process - metāla reducēšana - nereti saistīts ar elektrolīzi un pirometalurģiju.
Ar hidrometalurģijas metodēm iegūst galvenokārt cēlmetālus , izkliedētos metālus ( Ga, Ge, In, Re), varu, cinku, molibdēnu, volframu un citus.
Atsauce:
https://moodle.rtu.lv/public/course/view.php?id=38809