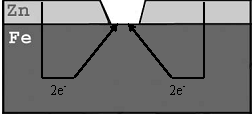
Katoda pārklājumi. Šajā gadījumā pārklājuma metāla elektroda potenciāls ir pozitīvāks nekā pamata metāla potenciāls. Kā piemēru var minēt alvotu dzelzi.
Attiecībā pret dzelzi kā katodpārklājumi būs visi mazāk aktīvie metāli jeb metāli ar pozitīvāku elektrodu potenciālu: Sn, Cu, Ni, Au, Ag u.c.
Attēls. Katodpārklājums
Kā nemetāliskos pārklājumus izmanto ziedes, laku un krāsu pārklājumus, polimēru pārklājumus, neorganiskus pārklājumus (emaljas).
Katodaizsardzība - elektronu blīvumu (koncentrāciju) aizsargājamai konstrukcijai var palielināt, pieslēdzot to ārējā līdzstrāvas avota negatīvajam polam, liekot tai visai kalpot kā katodam. Elektronu plūsmas rezultātā aizsargājamā metāla visi iepriekš esošie anoda un katoda apgabali iegūst vienādu potenciālu. Visa aizsargājamā metāla virsma sāk strādāt kā jauns katods un uz tā virsmas noris reducēšanās procesi.
Anodaizsardzība - Vienkāršoti šīs aizsardzības efektivitāti var skaidrot ar pasīvu oksīdu aizsargkārtiņu izveidošanos uz metālu vai to sakausējumu virsmas elektroķīmiskā ceļā (anoda process). Metāla konstrukciju pieslēdz līdzstrāvas avota negatīvajam polam, līdzīgi kā elektrolīzes procesā ar aktīvu (šķīstošu anodu). Sākumā notiek metāla oksidēšanās. Palielinot pieslēgto potenciālu, uz metāla virsmas izveidojas blīva, strāvu nevadoša oksīdu plēvīte un strāvas blīvums strauji samazinās.