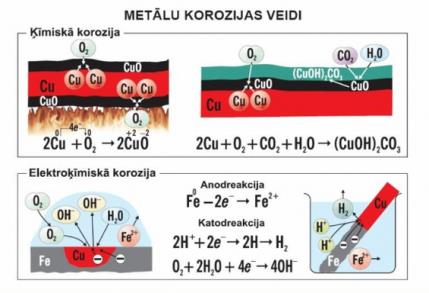
Anodā notiek aktīvākā metāla oksidēšanās:
Ja ūdens šķīdums skābekli nesatur, piemēram, tvaika katlu barojamais ūdens, kurš pirms ievadīšnas katlā atbrīvots no izšķīdušajām gāzēm, tad oksidētājs var būt tikai hidroksonija jons vai ūdens:
Elektrolīts veidojas, kondensējoties gaisa mitrumam un kondensātā izšķīstot gaisā esošajām gāzēm. Sausā atmosfērā elektrolīts neveidojas un korozija nenotiek.
Korozijas galvaniskais elements veidojas arī tad, ja pie dažādām metāla virsmas vietām ir atšķirīga skābekļa koncentrācija. Tādi elementi var izveidoties, piemēram, zem korozijas
produktu nosēdumiem, zem ūdens piliena vai pie kokā iedzītas naglas.
Vietās, kur skābekļa koncentrācija ir mazāka, veidojas anoda iecirkņi:
Vietas ar lielāku skābekļa koncentrāciju ir katoda iecirkņi
Tādējādi reālu konstrukciju un iekārtu ekspluatācija vienmēr ir saistīta ar elektroķīmisko koroziju. Tās ātrums ir ievērojami lielāks par ķīmiskās korozijas ātrumu un ietekmē iekārtu ekspluatācijas mūžu.
Elektroķīmiskās korozijas galvenie bojājuma veidi
Vienmērīgā jeb vispārīgā korozija - Šim korozijas veidam raksturīga vienmērīga korozijas produktu (rūsas) veidošanās ar aptuveni vienādu ātrumu uz visas metālu virsmas. Vispārīgās korozijas gadījumā varētu domāt, ka korozijas process pārsvarā notiek, pateicoties korozijas elementiem, kuros anoda un katoda virsmas nav izšķiramas.
Kontaktkorozija - tā ir iespējama:
1) ja ir elektrisks kontakts starp dažādiem metāliem;
2) ja ir elektrolīta (mitrums, kas satur dažādus jonus) klātbūtne. Ja metālu virsmas ir sausas, kontaktkorozijas ātrums var būt niecīgs.
3) ja ir vērā ņemama potenciālu starpība starp konstrukcijai izmantoto metālu potenciāliem, kuri noteikti attiecīgajā vidē (piemēram, jūras ūdenī) un temperatūrā.