Pirms 2500 gadiem sengrieķu filozofs Dēmokrits no Abdērām izteica domu, ka visas vielas sastāv no sīkām, neredzamām daļiņām - atomiem.
19. gadsimta sākumā (1903.g.) Dž. Daltons izvirzīja teoriju, ka atomi ir sīkas, nedalāmas lodītes.
Pētījumos par elektrisko strāvu vakuumā tika noskaidrots, ka no sakarsēta katoda izlido negatīvi lādētas daļiņas – elektroni. Tas palīdzēja Dž. Dž. Tomsonam izveidot jaunu atoma modeli, kurā pozitīvās vielas lodē ir izvietoti elektroni, kas veic harmoniskās svārstības ap līdzsvara stāvokli. Elektronu svārstībām piemīt noteiktas frekvences. Atoma modelis izskatās kā kēkss ar rozīnēm.
19. gadsimta sākumā (1903.g.) Dž. Daltons izvirzīja teoriju, ka atomi ir sīkas, nedalāmas lodītes.
Pētījumos par elektrisko strāvu vakuumā tika noskaidrots, ka no sakarsēta katoda izlido negatīvi lādētas daļiņas – elektroni. Tas palīdzēja Dž. Dž. Tomsonam izveidot jaunu atoma modeli, kurā pozitīvās vielas lodē ir izvietoti elektroni, kas veic harmoniskās svārstības ap līdzsvara stāvokli. Elektronu svārstībām piemīt noteiktas frekvences. Atoma modelis izskatās kā kēkss ar rozīnēm.
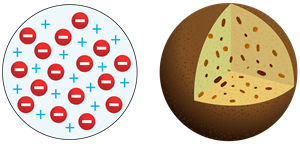
Tomsona modelī lodes—atoma diametrs ir .
Tomsona atoma modelis nevarēja izskaidrot atoma stabilitāti, atoma rentgena un gamma starojumu un līniju frekvenču dažādību atoma spektrā.
Pastāvēja arī citi atomu modeļi (1904.g.). Rodas viedoklis, ka atomā var būt tukšumi.
Tomsona atoma modelis nevarēja izskaidrot atoma stabilitāti, atoma rentgena un gamma starojumu un līniju frekvenču dažādību atoma spektrā.
Pastāvēja arī citi atomu modeļi (1904.g.). Rodas viedoklis, ka atomā var būt tukšumi.
|
William Thomson
(Lielbritānija) |
 |
|
Philipp Eduard Anton von Lenard
(Austrija, Vācija) |
 |
|
Hantaro Nagaoka
(Japāna) |
 |
1911.g. angļu fiziķis Ernests Rezerfords bombardēja zelta foliju ar alfa daļiņām. Pēc Tomsona atoma modeļa pozitīvi lādētajām alfa daļiņām vajadzētu brīvi iet cauri zelta folijas atomiem, bet eksperimenta rezultāti liecina, ka atomam ir tukšumi.

Rezerforda eksperimentā tika pierādīts, ka atoma centrā atrodas mazs, smags un pozitīvi lādēts atoma kodols. Tika aprēķināts atoma diametrs — un atoma kodola diametrs — .
Pēc šī eksperimenta veikšanas radās planetārais atoma modelis. Atomu veido pozitīvi lādēts blīvs kodols, kas atrodas centrā, un elektroni kā Saules sistēmā planētas riņķo ap kodolu, turklāt lielākā daļa masas koncentrēta kodolā, bet lielāko daļu atoma telpas aizpilda elektroni.
Pēc šī eksperimenta veikšanas radās planetārais atoma modelis. Atomu veido pozitīvi lādēts blīvs kodols, kas atrodas centrā, un elektroni kā Saules sistēmā planētas riņķo ap kodolu, turklāt lielākā daļa masas koncentrēta kodolā, bet lielāko daļu atoma telpas aizpilda elektroni.

Rezerforda atoma modeļa teorija neizskaidroja atoma stabilitāti, ar elektromagnētisko starojumu saistītās atomu īpašības: absorbcijas spektru un emisijas spektru.
Rezerforda atoma modeļa nepilnības mēģināja novērst dāņu fiziķis Nīlss Bors.
Pēc Bora pieņēmumiem elektronam, kas kustas pa noteiktu orbītu ap kodolu, ir noteikta enerģija, kas ir atkarīga no orbītas rādiusa (jo tālāk no kodola, jo lielāka enerģija).
Pēc Bora pieņēmumiem elektronam, kas kustas pa noteiktu orbītu ap kodolu, ir noteikta enerģija, kas ir atkarīga no orbītas rādiusa (jo tālāk no kodola, jo lielāka enerģija).
Svarīgi!
Ja atoms absorbē noteiktu enerģijas porciju, tad elektrons pāriet no orbītas ar mazāku rādiusu uz orbītu ar lielāku rādiusu. Ja atoms izstaro noteiktu enerģijas porciju, tad elektrons pāriet no orbītas ar lielāku rādiusu uz orbītu ar mazāku rādiusu.
Franču fiziķis Luijs Viktors de Broljī (1924.g.) izteica ideju, ka katrai kustībā esošai daļiņai atbilst noteikts vilnis, tajā skaitā arī elektronam atomā.
Mūsdienu priekšstati par atoma uzbūvi ir sekojoši:
- atomu kodoli sastāv no protoniem un neitroniem;
- elektronam piemīt gan daļiņu (piemīt masa un lādiņš), gan viļņu īpašības (spēj difraģēt);
- elektronam nav iespējams vienlaikus precīzi noteikt koordinātas un ātrumu.
Ja elektrons izplatās kā vilnis, tad tam nav noteiktas kustības trajektorijas, līdz ar to nav iespējams pateikt, kur precīzi elektrons atrodas. Tā vietā jānoskaidro, cik liela ir varbūtība, ka elektrons nonāks izraudzītājā telpas punktā. Tāpēc mūsdienās lieto jēdzienu elektrona mākonis. Šo mākoni var uzskatīt par elektronu, kas ir izpludināts telpā ap kodolu.
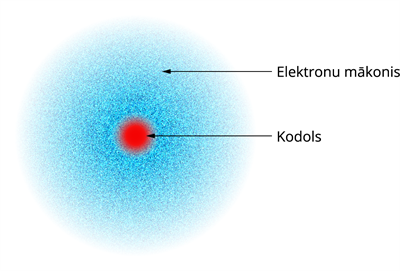

Vietās, kur šis mākonis ir biezāks, elektronu sastapt ir lielāka varbūtība nekā tur, kur tas ir plānāks.