OTRĀ SEMESTRA NOSLĒGUMA TESTI
Lielākā vielu daļa sastāv no molekulām
Vēl senos laikos daži zinātnieki ir izvirzījuši pieņēmumu, ka vielas sastāv no ļoti sīkām daļiņām, kuras nevar saskatīt ar acīm. Un tiešām, ja Tu ievietos karotīti cukura ūdenī, cukurs izšķīdīs – kļūs neredzams, bet daļiņas, no kurām sastāv šī viela taču nepazudīs. Par to liecina kaut tas, ka cukurūdenim saglabājas garša, kāda ir raksturīga cietam cukuram. Sīkas daļiņas, no kurām sastāv cukurs, sauc par cukura molekulām. Ūdens arī sastāv no ļoti sīkām daļiņām, kuras sauc par ūdens molekulām. Šķīšanas procesā cukura molekulas izvietojas starp ūdens molekulām.
Vēl senos laikos daži zinātnieki ir izvirzījuši pieņēmumu, ka vielas sastāv no ļoti sīkām daļiņām, kuras nevar saskatīt ar acīm. Un tiešām, ja Tu ievietos karotīti cukura ūdenī, cukurs izšķīdīs – kļūs neredzams, bet daļiņas, no kurām sastāv šī viela taču nepazudīs. Par to liecina kaut tas, ka cukurūdenim saglabājas garša, kāda ir raksturīga cietam cukuram. Sīkas daļiņas, no kurām sastāv cukurs, sauc par cukura molekulām. Ūdens arī sastāv no ļoti sīkām daļiņām, kuras sauc par ūdens molekulām. Šķīšanas procesā cukura molekulas izvietojas starp ūdens molekulām.

Sengrieķu domātājs Dēmokrits (apmēram 460.-370. gads p.m.ē.).
Viens no pirmajiem formulējis pieņēmumu, ka vielas sastāv no ļoti sīkām nedalāmām daļiņām.
Molekula ir vissīkākā vielas daļiņa, kas saglabā vairākas vielai raksturīgas īpašības.
Vielas, kas atrodas cietā agregātstāvoklī, parasti veido kristālus. Kristālos molekulas izvietojas sakārtoti jeb simetriski un tie savstarpēji pievelkas. Kristālā molekulas nemitīgi kustās – svārstās ap kādu punktu telpā, kuru sauc par kristāliskā režģa mezglu. Kristālā starp molekulām ir attālumi.
Viens no pirmajiem formulējis pieņēmumu, ka vielas sastāv no ļoti sīkām nedalāmām daļiņām.
Molekula ir vissīkākā vielas daļiņa, kas saglabā vairākas vielai raksturīgas īpašības.
Vielas, kas atrodas cietā agregātstāvoklī, parasti veido kristālus. Kristālos molekulas izvietojas sakārtoti jeb simetriski un tie savstarpēji pievelkas. Kristālā molekulas nemitīgi kustās – svārstās ap kādu punktu telpā, kuru sauc par kristāliskā režģa mezglu. Kristālā starp molekulām ir attālumi.

Ūdens cietā agregātstāvoklī (ledus gabals).
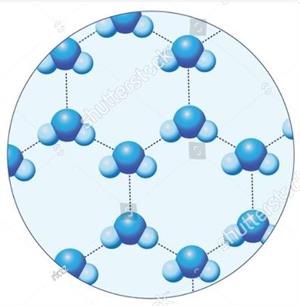
Ūdens kristāliskā režģa modelis (ūdens molekulas izvietojas sakārtoti).
Pastāv cietas vielas, kuras neveido kristālus. Šādās vielās tāpat kā šķīdumos, daļiņas, no kurām viela sastāv, izvietojas nesakārtoti. Šādas vielas sauc par amorfām vielām. Kā šādas vielas piemēru var nosaukt gudronu jeb melnas krāsas “pīķi”, no kura izgatavo asfaltu.

Temperatūrai pieaugot palielinās molekulu kustības ātrums, palielinās attālums starp daļiņām un noteiktā temperatūrā (to sauc par kušanas temperatūru) molekulu savstarpējās pievilkšanas spēks kļūst tik vājš, ka kristāls izjūk un viela pāriet šķidrā agregātstāvoklī.
Šķidrumos molekulu kustības ātrums kļūst lielāks. Mainās arī šo daļiņu kustības ātrums: ja kristālos molekulas svārstās ap kristāliskā režģa mezgliem, tad šķidrumos, kaut nelielā mērā saglabājas savstarpējās pievilkšanas spēki, molekulas pārvietojas brīvi un nesakārtoti.

Ja temperatūra palielinās vēl vairāk, molekulu kustības ātrums kļūst vēl lielāks, attālums starp molekulām kļūst vēl lielāks, un rezultātā savstarpējās pievilkšanas spēks starp šīm daļiņām praktiski izzūd. Viela pāriet gāzveida agregātstāvoklī.
Gāzēs (salīdzinot ar cietām un šķidrām vielām) attālums starp molekulām ir ļoti liels. Šīs daļiņas pārvietojas ar ļoti lielu ātrumu, bet pēc kustības rakstura gāzveida vielas ir līdzīgas šķidrumiem – molekulas tajos pārvietojas arī brīvi un nesakārtoti.
Temperatūrai pazeminoties, molekulu kustības ātrums samazinās, attālums starp daļiņām kļūst mazāks, savstarpējas molekulu pievilkšanās spēks kļūst stiprāks. Kā rezultāts tvaiks kondensējās un viela pāriet šķidrā agregātstāvoklī. Ja temperatūra kļūst vēl zemākā turpinās izmaiņas, kuras jau iepriekš ir aprakstītas, un viela sacietē jeb pariet cietā agregātstāvoklī.
Ūdenim pāreja no cieta agregātstāvokļa šķidrajā un otrādi norisinās temperatūrā 0 °C, bet pāreja no šķidra agregātstāvokļa gāzveida un otrādi norisinās temperatūrā +100 °C.
