OTRĀ SEMESTRA NOSLĒGUMA TESTI
Dzīva organisma normālu darbību un fizioloģiskos procesus regulē un ietekmē bioloģiski aktīvas organiskās vielas, kā, piemēram, hormoni un enzīmi.
Enzīms jeb ferments ir lielmolekulāra bioloģiski aktīva viela, kas paātrina jeb katalizē ķīmisko reakciju ātrumu organismā.
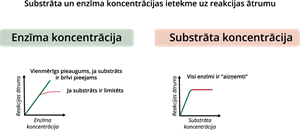
Ķīmiskās reakcijas laikā enzīms iedarbojas uz substrātu un izmaina to, taču pati enzīma molekula savu struktūru nemaina. Substrāts ir viela, kas tiek pārveidota enzīmu katalizētajās reakcijās. Enzīms reaģē ar substrātu, to pārveido un atbrīvojas, lai no jauna stātos reakcijā ar nākošo substrāta molekulu. Palielinoties substrāta koncentrācijai palielinās arī reakcijas ātrums līdz punktam, kad visi enzīmi ir iesaistīti vielmaiņas reakcijā un brīvu vairs nav.
Svarīgi!
Enzīms ar substrātu saistās pēc "atslēgas - slēdzenes" principa: konkrēts enzīms spēj saistīt tikai konkrētu substrātu.
Enzīmu darbība ir specifiska - katrs enzīms spēj katalizēt tikai noteikta veida bioķīmisko reakciju. Piemēram, amilāze ir enzīms, kurš mutes dobumā šķeļ cieti.

Lielākā daļa no enzīmiem ir olbaltumvielas ar trešējo struktūru, tādēļ to darbība ir atkarīga no apkārtējās vides faktoriem. Normālos apstākļos katalītiskās reakcijas noris diezgan ātri, tomēr pastāv faktori, kas var ietekmēt to darbības ātrumu. Enzīmi ir pakļauti denaturācijai jeb struktūras izjaukšanai, ja šie darbību ietekmējošie faktori pārsniedz pieļaujamās robežas.
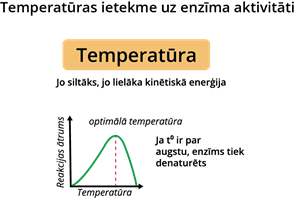
Viens no šiem faktoriem ir temperatūra. Paaugstinoties temperatūrai, enzīmu aktivitāte pieaug. Ja temperatūra paceļas augstāk par noteiktu punktu, enzīma aktivitāte vairs nepalielinās, bet pēc brīža sāk strauji pazemināties, jo enzīms denaturējas. Denaturācijas laikā enzīma molekulas forma pārmainās, tādēļ tā vairs nespēj efektīvi saistīties ar atbilstošo substrātu.
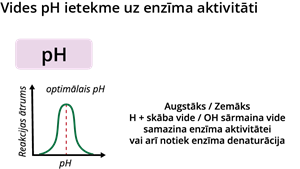
Tieši tāpat katra enzīma darbībai pastāv optimālais vides pH, kurā reakcijas ātrums ir vislielākais. Piemēram, cilvēka kuņģī enzīms pepsīns šķeļ olbaltumvielas tikai skābā vidē. Ārpus vielu normālā pH līmeņa arī var notikt enzīmu denaturācija.
Enzīmu darbībai nepieciešamie apstākļi ir jāievēro, lietojot sadzīves ķīmijas līdzekļus, kuri satur enzīmus, piemēram, veļas mazgāšanas līdzekļiem mēdz būt norādīta temperatūra, kurā tie darbojas.
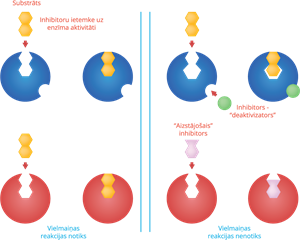
Enzīmi ir jūtīgi pret dažādām vielām, kas kavē vai pārtrauc to darbību. Šādas vielas sauc par inhibitoriem. Daudzi pretsāpju medikamenti satur vielas, kas nomāc enzīmus, kas katalizē procesus, kas paaugstina nervgaļu jūtību. Tādejādi šie medikamenti nevis ārstē sāpju cēloni, bet novērš seku izpausmi. Kā inhibitori darbojas lielākā daļa indes, piemēram, tvana gāze, cianīds u.c.
Svarīgi!
Enzīma nosaukumu galvenokārt veido, pievienojot galotni – āze tās vielas vai reakcijas nosaukumam, uz kuru enzīms iedarbojas. Piemēram, lipāze katalizē lipīdu sadalīšanu, hidrolāzes ietekmē hidrolīzes reakcijas.
Viszināmākie ir gremošanas enzīmi (skat.tab.), kas galvenokārt ir hidrolāzes. Dažus šos enzīmus izmanto medicīnā kā preparātus, piemēram, kuņģa un zarnu slimību gadījumā, lai uzlabotu barības vielu šķelšanu gremošanas traktā.

Šūnā enzīmu skaits sniedzas simtos, un tie atrodas noteiktā telpiskā kārtībā membrānu veidojumos, piemēram, endoplazmatiskā tīkla membrānās. Katrai reakcijai ir savi specifiski enzīmi, tādēļ šūna visu laiku regulē, kādiem enzīmiem šūnā katrā momentā jābūt aktīvā stāvoklī. Tādēļ šūnā var atrasties arī enzīmi, kuri reakcijai nav nepieciešami.
Katrā dzīvā šūnā veidojas enzīms katalāze, kas sadala šūnām kaitīgo ūdeņraža peroksīdu ( rodas vielmaiņā kā starpprodukts) par organismam nekaitīgām vielām – ūdeni un skābekli. Visaktīvāk katalāze veidojas tādās šūnās un audos, kuros ir intensīvi notiek vielmaiņas reakcijas. Jo aktīvāk darbojas katalāze, jo vairāk skābekļa izdalās. Katalāze uzkrājas peroksisomās. Šo katalāzes īpašību izmanto arī medicīnā, lai attīrītu brūci no netīrumiem. Ja uz nobrāzuma vai citas nelielas brūces uzlej ūdeņraža peroksīda šķīdumu (ūdeņraža pārskābi), šūnās esoša katalāze to sadala, bet radušies skābekļa burbulīši izvada netīrumus un mikroorganismus no brūcēm.